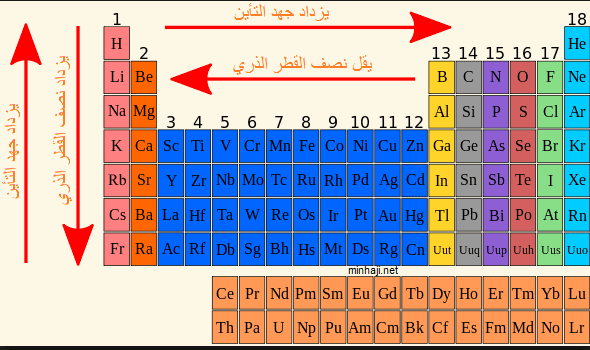
يمكن تعريف طاقة التأين بأنها الطاقة اللازمة لنزع إلكترون من المدار الأخير للذرة ويعبر عن مدى ترابط الالكترون بالذرة فكلما كان ارتباط الإلكترون بالذرة كبيراً كانت طاقة التأين كبيرة، وتقاس بوحدة الكيلو جول / مول، وهناك العديد من الأنواع لطاقة التأين: طاقة التأين الآولى، وطاقة التأين الثانية، وطاقة التأين الثالثة، حيث إن طاقة التأين الآولى هي الطاقة اللازمة لنزع الإلكترون الأول من الذرة أما طاقة التأين الثانية فهي الطاقة اللازمة لنزع الإلكترون الثاني من الذرة أما طاقة التأين الثالثة فهي الطاقة اللازمة لنزع الإلكترون الثالث من الذرة، وهكذا.
العوامل التي تتعلق بطاقة التأين
هناك العديد من العوامل التي تعتمد عليها طاقة التأين بيانها على النحو الآتي:
** طاقة التأين الآولى أقل من طاقة التأين الثانية، وطاقة التأين الثانية أقل من طاقة التأين الثالثة، يمكن توضيح هذا السبب كما يلي: عندما تفقد الذرة إلكترون كما هو الحال في طاقة التأين الآولى تصبح شحنتها موجبة، وبالتالي عندما تفقد الإلكترون الثاني كما هو الحال في طاقة التأين الثانية فإنه قوة الجذب بين الشحنة الموجبة للذرة والإلكترون السالب تصبح أكبر وبالتالي ارتباطه بالنواه يصبح أكبر، وطاقة التأين تكون أكبر حيث يصبح من الصعب فصل الإلكترون عن الذرة الموجبة، وكذلك الحال بالنسبة إلى طاقة التأين الثالثة.
** كلما زاد نصف قطر الذرة أي زاد حجمها تكون طاقة التأين أقل، والسبب في ذلك أنه يصبح الإلكترون في المدار الاخير بعيداً عن النواة وبالتالي فإنه يسهل نزعه من النواة، أما إذا كان نصف قطر الذرة قليل أي أن حجمها قليل فإنه يصعب نزع الإلكترون من الذرة لأن قوة الجذب بين الإلكترون والنواة تكون أكبر وبناءً على ذلك فإن طاقة التأين لعنصر الكالسيوم تكون أقل من طاقة التأين لعنصر الكلور والسبب في ذلك أن حجم ذرة الكالسيوم أكبر وبالتالي يسهل إزالة إلكترون من مدارها الأخير على العكس من ذرة الكلور التي يصعب إزالة إلكترون منها نظراً لحجمها الصغير.
أهمية طاقة التأين
يساعد فهم طاقة التأين في تفسير كيف تقوم بعض الذرات بعمل روابط تساهمية وبعضها الآخر يقوم بعمل روابط أيونية فإّا كان الفرق بين طاقتي التأين للذرتين المرتبطتين معاً كبيراً فإن الرابطة في هذه الحالة تكون أيونية أي أن أحد الذرات سوف تفقد إلكتروناً والأخرى سوف تكسب هذا الإلكترون كما هو الحال في ذرتي الكلور والصوديوم حيث تبلغ طاقة التأين لذرة الكلور 1251.1 كيلوجول / مول، وطاقة التأين لذرة الصوديوم 496 كيلو جول / مول (طاقة التأين الآولى) وهذا يعني أن الفرق بينهما كبير لذا تكون الرابطة أيونية.
أما إذا كان الفرق بين طاقة التأين للذرتين المرتبطتين صغيراً فإن الرابطة تكون تساهمية أي أن الذرتين تتشارك في الإلكترونات كما هو الحال في ذرتي الكربون والكلور اللتان تكونان روابط تساهمية بينهما.
https://www.britannica.com/science/ionization-energy
https://chemed.chem.purdue.edu/genchem/topicreview/bp/ch7/ie_ea.html